npj Aging | (2025) 11:65.
doi.org
Sirtuins and their role in ovarian agingrelated fibrosis predisposing to ovarian cancer
Arkadiusz Grzeczka, Agnieszka Skowronska, Sara Sepe, Mariusz T. Skowronski, Paweł Kordowitzki
Сиртуины и их роль в фиброзе яичников, связанном со старением и предрасполагающем к раку яичников
Введение
Для понимания сложности процессов старения женской репродуктивной системы важнейшую информацию дают ранние маркеры старения яичников, фиброза и рака. Их изменения говорят о нарушении сложных клеточных процессов, которые происходят по мере старения женских яичников, что имеет важное значение для лечения бесплодия и стратегий репродуктивного здоровья (рис. 1) . Среди различных регуляторов клеточного гомеостаза семейство сиртуинов (SIRT), включающее семь НАД⁺-зависимых ферментов, SIRT1–SIRT7, выступает в качестве важнейших сенсоров энергии и окислительно-восстановительного статуса.
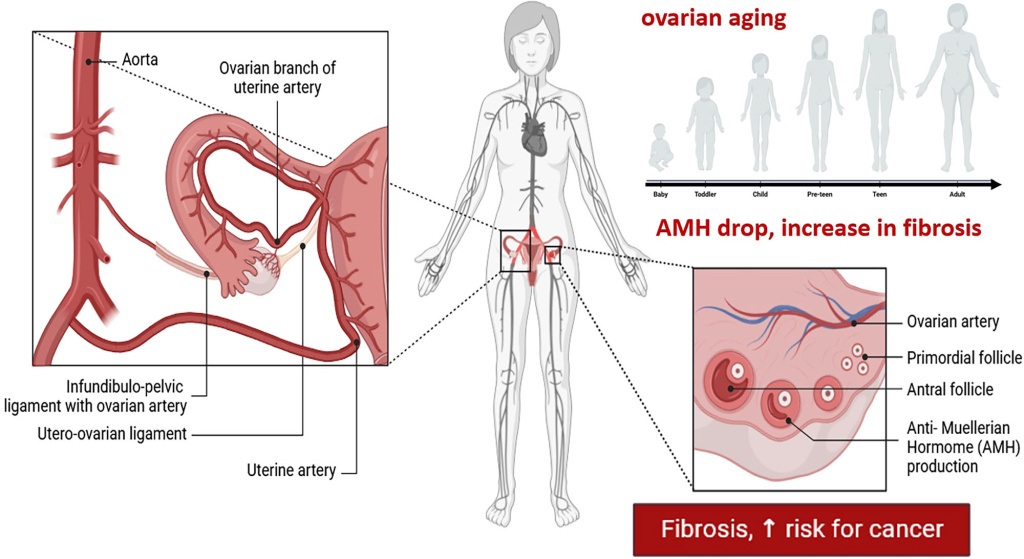 Рисунок 1. Схема, демонстрирующая старение яичников и его влияние на снижение количества антральных фолликулов (АФК) и антимюллерова гормона (АМГ) в кровотоке женщин с возрастом
Рисунок 1. Схема, демонстрирующая старение яичников и его влияние на снижение количества антральных фолликулов (АФК) и антимюллерова гормона (АМГ) в кровотоке женщин с возрастом
SIRT представляют собой семейство из семи ферментов: SIRT1-7, которые играют ключевую роль в регуляции функции белка посредством посттрансляционных модификаций, в первую очередь путем удаления ацетильных групп. Их роль в контроле окислительного стресса, геномной стабильности и судьбы клеток позиционирует их как центральные модуляторы как фиброза яичников, так и опухолевых процессов. SIRT1 широко известен своими антифиброзными и противоопухолевыми эффектами посредством регуляции путей TGF-β, p53 и NF-κB, хотя при некоторых видах рака его сверхэкспрессия может поддерживать прогрессирование опухоли. SIRT2 регулирует клеточное деление и, как было показано, влияет на фиброзную сигнализацию через DKK1 и Smad3, а также проявляет противоопухолевые свойства при раке яичников. SIRT3, основная митохондриальная деацетилаза, защищает от окислительного стресса и поддерживает функцию митохондрий; ее снижение с возрастом способствует фиброзу и связано с неблагоприятным прогнозом рака яичников. SIRT4, хотя и менее изучен, влияет на созревание ооцитов и может способствовать митотической стабильности; его аномальная экспрессия связана как со старением яичников, так и со злокачественными новообразованиями. SIRT5, благодаря своей десукцинилазной активности, модулирует метаболические ферменты, участвующие в окислительно-восстановительном балансе; он может способствовать химиорезистентности опухолей яичников и был обнаружен измененным при фиброзных заболеваниях яичников. Ядерные сиртуины SIRT6 и SIRT7 жизненно важны для ремоделирования хроматина и восстановления ДНК. Было показано, что SIRT6 противодействует отложению фиброзного матрикса и окислительному стрессу, в то время как SIRT7 поддерживает качество ооцитов. При этом оба этих белка демонстрируют нарушение регуляции при старении яичников и раке.
Поскольку уровни NAD⁺ снижаются с возрастом, активность всех SIRT уменьшается, что способствует нарушению регуляции клеточных реакций на стресс, ремоделированию внеклеточного матрикса и, в конечном итоге, созданию микросреды, благоприятствующей как фиброзу, так и развитию опухоли. Возрастная дисфункция яичников связана со снижением уровней SIRT, то есть снижением овариального резерва, которое связано со снижением уровней SIRT1, SIRT3 и SIRT6. Еще одной особенностью старения является фиброз яичников, и, как упоминалось ранее, фиброз может способствовать состояниям, аналогичным предметастатической нише. Фиброз, ассоциированный с опухолью, может иметь множество функций, включая устойчивость к лекарственным препаратам. Действительно, нацеливание на трансформирующий фактор роста-β (TGF-β), приводящее к ингибированию фиброза, может сенсибилизировать опухоль к иммунотерапии. Однако некоторые исследования утверждают, что фиброз яичников может способствовать развитию микросреды, благоприятной для роста опухоли, мобилизуя компоненты ECM, в первую очередь коллаген, и активируя фиброзные пути, например TGF-β, которые тесно связаны с потенциалом клеток подвергаться эпителиально-мезенхимальному переходу (EMT). Интересно, что большинство злокачественных опухолей сопровождаются тяжелыми стромальными изменениями, а повышение жесткости ткани яичников облегчает инвазию опухоли или метастазирование. Фиброзные яичники встречаются также у женщин в постменопаузе и пожилом возрасте. В этом возрасте женщины наиболее предрасположены к развитию рака яичников (РЯ). Возрастное накопление повреждений, вызванных нарастающим оксидативно-воспалительным стрессом, способствует ухудшению изменений в строме и капсуле яичников, что может быть связано с более высокой предрасположенностью к раку яичников.
Целью данного обзора является изучение многогранной роли сиртуинов в фиброзе яичников, связанном со старением, и их вклада в предрасположенность к раку яичников, интегрируя их молекулярные действия в ключевые сигнальные пути и физиологические контексты.
Выводы
Сиртуины, благодаря своей обширной субклеточной локализации, оказывают важное влияние на энергетический обмен (НАД+), от которого зависят клеточные функции, и влияют на ключевые сигнальные пути, непосредственно связанные с фиброзом яичников (Smads, TGF-β). Как мы уже отмечали, кинетика SIRT1 и SIRT3 на сегодняшний день изучена лучше всего – и это неудивительно, учитывая их несомненное влияние на транскрипцию генов пути Smads (в случае SIRT1) и митохондриальный метаболизм (в случае SIRT3). Что касается остальных сиртуинов, то можно ожидать, что SIRT6 и SIRT7 будут выполнять функции, аналогичные функциям SIRT1, благодаря их схожей локализации. То же самое относится к SIRT3 и SIRT5. Хотя функции SIRT2 и SIRT4 в яичниках остаются недостаточно изученными, будущие исследования могут раскрыть их потенциальные роли, проводя параллели с их известной активностью в других тканях, например, участие SIRT2 в регуляции клеточного цикла, а также роль SIRT4 в митохондриальном метаболизме и реакции на стресс.
Было установлено, что ингибирование основных путей воспалительного и окислительного стресса NLRP3, NFkB снижает экспрессию маркеров фиброза (α-SMA) в ткани яичников стареющих мышей, мышей с индуцированным фиброзом, а также в ткани яичников женщин в постменопаузе. Кроме того, сиртуины взаимодействуют с ключевыми путями, поддерживающими митохондриальную приспособленность и биогенез (PGC-1α), и факторами транскрипции (Nrf2, FOXO), обеспечивающими адекватную экспрессию антиоксидантных ферментов. Отдельного наблюдения заслуживает интересная взаимосвязь между сиртуинами и AMPK, которая, например, приводит к изменениям популяции макрофагов, что позволяет выявить истинные причины фиброза яичников. В контексте опухолегенеза была выявлена интересная взаимосвязь между сиртуинами и важными фиброзными путями при раке яичников. Действительно, сиртуины могут моделировать процесс EMТ, ключевой процесс метастазирования, а сверхэкспрессия сиртуинов смогла снизить отложение коллагена у стареющих мышей. Хотя терапевтические агенты, такие как метформин (агонист AMPK и SIRT1), демонстрируют потенциал в смягчении фиброза яичников, а ресвератрол может обеспечивать еще более сильную активацию SIRT1, необходимы дальнейшие исследования для устранения таких ограничений, как побочные эффекты и нехватка надежных клинических данных у людей, подтверждающих их эффективность и безопасность. Действие ресвератрола ограничено его низкой биодоступностью, а его взаимодействие с другими препаратами (из-за ингибирования цитохромов P450) все еще плохо изучено. С другой стороны, метформин может приводить к многочисленным нарушениям пищеварительной и эндокринной систем.






