npj Aging | (2024) 10:41.
doi.org
The paradox of senescent-marker positive cancer cells: challenges and opportunities
Emily A. O’Sullivan, Ryan Wallis, Federica Mossa, Cleo L.Bishop
Парадокс стареющих раковых клеток, позитивных по маркерам старения: проблемы и возможности
Введение
Старение — это гомеостатическая клеточная программа, которая активируется в ответ на множество стрессоров. В ответ ингибиторы циклинзависимой киназы (CDKi), такие как p16INK4a (p16; кодируется локусом CDKN2A) и/или p21WAF-1/CAP1 (p21), активируются для инициирования и поддержания стабильной остановки клеточного цикла. Еще одной определяющей чертой старения является измененный, гиперсекреторный фенотип, состав которого зависит как от триггера, так и от времени. Секреторный фенотип, ассоциированный со старением (SASP), может содержать множество компонентов, включая белки (интерлейкины, цитокины, хемокины, факторы роста, протеазы и т. д.), небольшие внеклеточные везикулы, биоактивные липиды и некодирующие нуклеиновые кислоты (например, микроРНК, фрагменты цитоплазматического хроматина). Появившиеся данные свидетельствуют о том, что физиологические условия определяют, будет ли паракринный эффект SASP иметь благоприятные или пагубные последствия для локальной тканевой микросреды (ТМЕ).
Индуцированное онкогенами старение (OIS) является установленной формой преждевременного старения, которое может быть вызвано активацией онкогена или инактивацией супрессора опухоли. Действие OIS заключается в предотвращении репликации поврежденных клеток, подверженных риску злокачественной трансформации, и, следовательно, считается ключевым механизмом супрессора опухоли. Хотя механизм не до конца понятен, но замедление старения относится к восстановлению пролиферативного потенциала после индукции старения. Последующие последовательные раунды подверженной ошибкам репликации в предраковых клетках могут привести к накоплению большего количества повреждений ДНК и повышению геномной нестабильности, тем самым позволяя происходить дальнейшим протуморогенным мутациям. Таким образом, эволюция рака может привести к пролиферативным опухолевым клеткам, содержащим мутации в ключевых эффекторных молекулах старения. Однако, напротив, некоторые опухоли способны пролиферировать, одновременно экспрессируя высокие уровни ключевых эффекторных белков старения. Эти загадочные раковые клетки с положительными показателями старения (Sen-Mark+) до сих пор привлекали сравнительно мало внимания.
В этом обзоре мы описываем открытие OIS и обобщаем роль старения как внутреннего механизма подавления опухолей. Мы приводим примеры, в которых незлокачественные стареющие клетки вносят вклад в микроокружение опухоли (TME), в частности, появляются доказательства того, что такие стареющие клетки могут быть обнаружены в строме. Затем мы описываем доказательства для раковых клеток Sen-Mark+, уделяя особое внимание ключевым эффекторам старения p16 и p21. Мы описываем текущее понимание различных прогностических последствий для рака Sen-Mark+ и рассматриваем проблемы при попытке классификации раковых клеток Sen-Mark+. Наконец, мы излагаем терапевтические возможности для таргетирования рака Sen-Mark+ и обсуждаем важные соображения относительно таких режимов лечения. Определения ключевых процессов, связанных со старением, изображены на рисунке 1.
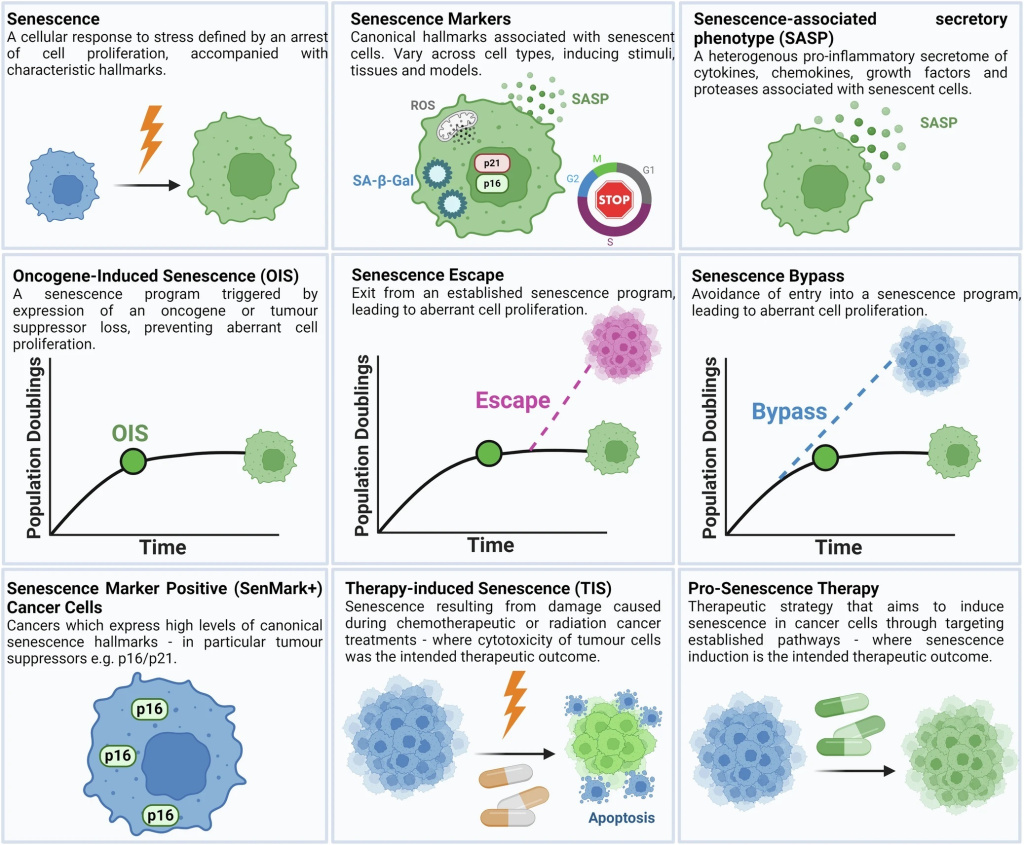 Рисунок 1. Ключевые процессы, связанные со старением
Рисунок 1. Ключевые процессы, связанные со старением
Перспективы
Повышенная экспрессия p16 и p21 в подгруппе раковых заболеваний является озадачивающим парадоксом, где в некоторых ситуациях экспрессия CDKi противоестественно связана с плохим исходом для пациента. Более того, высокие уровни экспрессии часто являются предиктором резистентности к терапии. Интересно, что, по-видимому, локализация этих CDKi важна, при этом цитоплазматическая экспрессия p21 или p16 связана с уменьшением общей выживаемости. Локализация этих белков поднимает интересные вопросы , касающиеся альтернативной функциональности и регуляции, которые, возможно , позволили раковым клеткам избежать индукции старения или обойти ее. Профилактическая терапия – это захватывающая область продолжающихся исследований, направленная на то, чтобы специфически стимулировать старение раковых клеток, чтобы активировать внутренний механизм подавления опухоли. Это также может сочетаться с сенолитиками в рамках стратегии «один-два удара». Альтернативный подход мог бы включать повторную сенсибилизацию раковых клеток к их эндогенной сверхэкспрессии CDKi, p16 и/или p21. Чтобы полностью выяснить терапевтический потенциал повторной сенсибилизации сенесцентно-позитивных раковых клеток, необходимы дополнительные исследования, которые позволят понять потенциальную неканоническую роль CDKi в контексте различной клеточной локализации. Соединения, способствующие локализации CDKi в ядре, могут обеспечить ранее недооцененный механизм индуцирования преждевременного старения специфичным для рака образом.
Наблюдение за тем, что раковые клетки обладают потенциалом к размножению и стимулируют развитие опухоли, сохраняя при этом ключевые стареющие белки, такие как р16, поднимает интригующие вопросы о механизмах, лежащих в основе прогрессирования рака. Кроме того, различная клеточная локализация p16 в различных типах рака подчеркивает необходимость изучения альтернативной роли и механизмов регуляции p16, которые могут использоваться раковыми клетками для предотвращения индукции старения. Более того, сложное взаимодействие между p16 и другими супрессорами опухолей, включая p53 и p21, добавляет еще один уровень сложности к нашему пониманию биологии рака. Например, субклеточная локализация p16 и p21 была связана с дифференциальными прогностическими последствиями при различных типах рака. Однако проблемы с идентификацией стареющих раковых клеток остаются нерешенными, особенно в контексте раковых клеток с положительным маркером старения. Преодоление этих проблем будет иметь важное значение для разработки новых целевых методов лечения, основанных на профилактике старения. В целом, выяснение молекулярных механизмов, лежащих в основе сверхэкспрессии CDKi при раке, и их взаимодействия с супрессорами опухолей обещает разработку терапевтических стратегий и прогностических маркеров в лечении рака. Продолжение исследований в этой области необходимо для раскрытия всего спектра функций p16 и p21 и, следовательно, их значения для биологии и терапии рака.
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)






